پروتئومیکس Proteomics
واژه پروتئوم (Proteome) به تمام پروتئینهایی اطلاق میشود كه به وسیله موجود زنده تولید میشود. برخلاف ژنوم(Genome) که ماهیتی ثابت و پایدار دارد، پروتئوم ماهیتی دینامیک و متغیر دارد و به عنوان پروتئینهای موجود در یك سلول، بافت و یا اندام ارگانیسم در یك مقطع زمانی مشخص تعریف میشود. ژنوم انسان حدود 22000 ژن را کد میکند این درحالی است که تخمین زده میشود که تعداد پروتئینهایی که از طریق به هم متصل شدن متناوب (Alternative splicing) و یا تغییرات پس از ترجمه (Post-translational modification) بوجود میآیند حداقل 50 برابر این تعداد باشند. مشخص شده كه پروتئینها، پس از ترجمه، در پاسخ به تغییرات سیگنالهای درون سلولی و بیرون سلولی، تغییر مییابند.بیش از 200 نوع از این تغییرات (که نقش زیادی در پیام دهی و عملکرد یک سلول دارند) بر روی پروتئینهای مختلف شناسایی شدهاند که مهمترین آنها شامل فسفوریلاسیون، استیلاسیون، گلیکوزیلاسیون و نیتراسیون میباشند.
تاریخچه
پروتئومیكس در سال 1975 و با معرفی الکتروفورز دو بعدی-قلب تكنولوژی پروتئوم- به وسیلهFarrell و Klosejبمنظور نقشهیابی پروتئینهای باکتری ای کولای و سپس موش و خوکچه هندی شروع شد، با این همه واژه پروتئومیكس تا سال 1995 معرفی نشده بود.
با شروع توالییابی ژنوم انسان در سال 2000، دوره پس از ژنومیک (Post-Genomic) شروع شد كه پروتئومیكس بخش مهمی از آنرا شامل میشود.
هدفپروتئومیكس كامل كردن نقشه سه بعدی تمام پروتئینهایی است كه در سلول اثر متقابل دارند كه درسال 2001 در میكروارگانیسمHelicobacter pylori این هدف میسر شد.
كاربردهای پروتئومیكس در ژنتیك و اصلاح نباتات
- بررسی تنوع ژنتیكی شامل تفاوتهای ژنتیكی درون و بین گونهای، تشخیص واریتهها، لاینها و ارقام
- بیان ژنوم؛ مشخص كردن موتانتها، تغییر پذیری بیان پروتئینها براساس اندام و مرحله رشدی گیاه، شناسایی و نشان دادن پروتئینهای حساس به استرسهای غیر زنده
- تهیه نقشه ژنتیكی و شناسایی پروتئینهای معرف
نقش اطلاعات ژنومی در پروتئومیکس
رشد پروتئومیكس، نتیجه پیشرفت توالییابی نوكلئوتیدی توالیهای هدف بیان شده و DNA ژنومی در مقیاس گسترده میباشد. بدون این اطلاعات، حتی با وجود پیشرفتهاییكه در زمینه MSصورت گرفته است، امکان شناسایی پروتئینها فراهم نمیشد.
مقایسه پروتئومیكس و ژنومیكس
برخلاف ژنومیكس (Genomics) كه شكل ثابتی از ژنوم در یك ارگانیسم وجود دارد، در پروتئومیکس تعداد زیادی پروتئوم در یك ارگانیسم وجود دارند. بنابراین پروتئومیكس زمینه بسیار گستردهتری نسبت به ژنومیكس دارد و پیچیده بودن پروتئوم با این گفته نشان داده میشود.
دسته بندی پروتئومیكس
پروتئومیكس بیانی[Expression Proteomics] : با استخراج پروتئینهای بیان شده از سلول یا بافت در ارتباط است.
پروتئومیكس ساختاری[Structural Proteomics] : بمنظور تعیین ساختار سه بعدی پروتئین انجام میشود.
پروتئومیكس عملکردی[Functional Proteomics] : عملکرد پروتئینهای مختلف را بررسی میكند.
شیمو پروتئومیكس[Chemo Proteomics] : معادل ژنومیكس شیمیایی است و زمانی كه پروتئومیك به منظور مطالعه چگونگی اثر متقابل مولکولهای كوچك با سلول، مورد استفاده قرار میگیرد، از این عبارت استفاده میشود.
پروتئومیكس نقشه سلولی [Cell- Map Proteomics] : در تعیین موقعیت پروتئینها در سلول و اثر متقابل پروتئین- پروتئین نقش دارد.
گلیکو پروتئومیكس[Glicoproteomics] : به منظور مطالعه گلیکو پروتئینها میباشد.
تكنولوژی پروتئومیكس
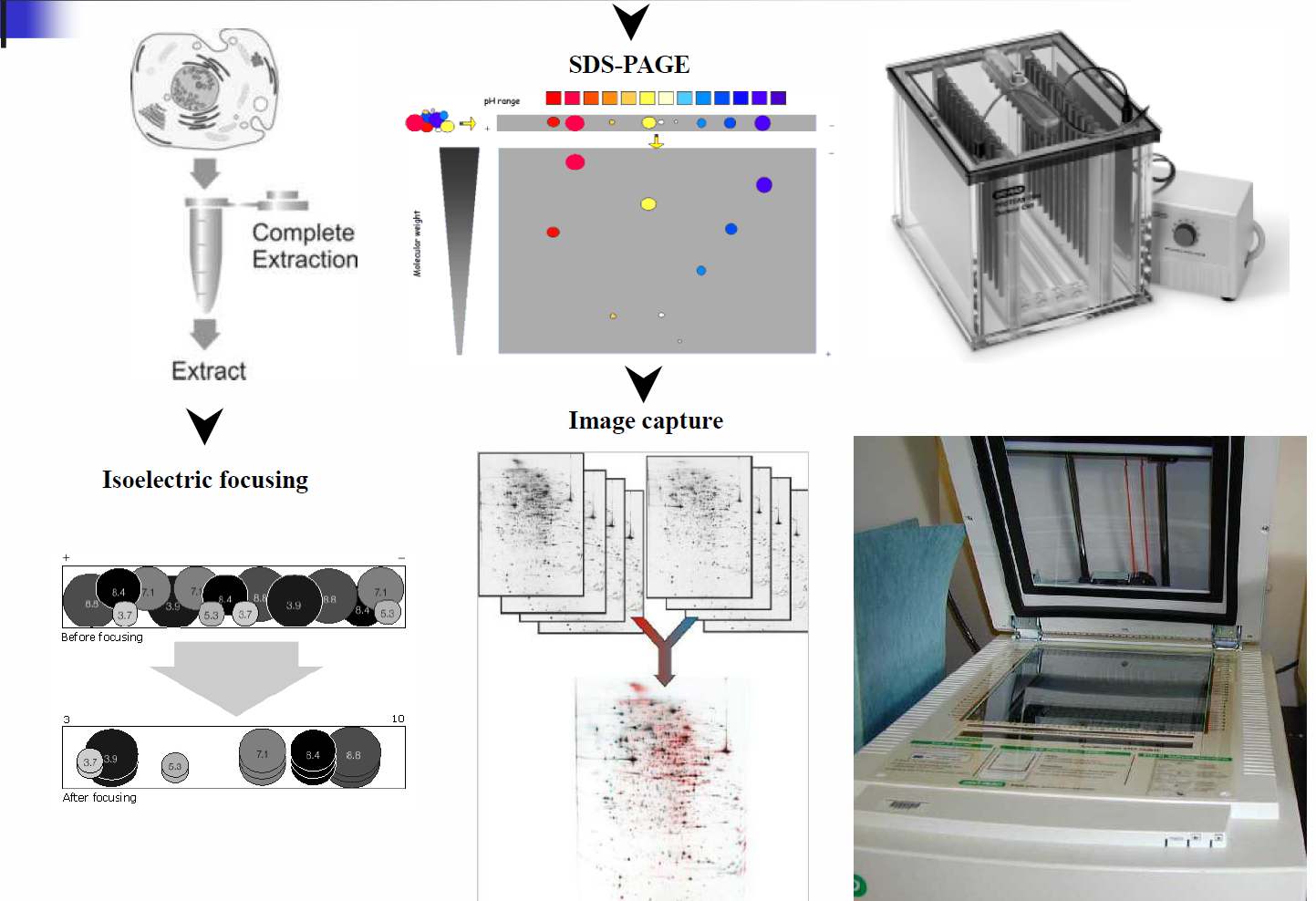
یك آزمایش تیپیك پروتئومیكس (مانند پروفیلینگ بیان پروتئین) میتواند به مراحل زیر تقسیم شود:
جداسازی و ایزوله كردن پروتئین از یك سلول، بافت یا اندام
كسب اطلاعات در مورد ساختار پروتئین به منظور شناسایی پروتئین یا تشخیص و توصیف آن
بكارگیری مشاهدات یا بانکهای اطلاعاتی
جداسازی و ایزوله كردن پروتئینها:
تجزیه كمپلكس مخلوطهای پروتئینی به اجزای خود، بمنظور شناسایی و توصیف پروتئینها.
تكنولوژی غالب برای جداسازی پروتئین و ایزوله کردن آن الكتروفورز با ژل اکریل آمید میباشد.
الکتروفورز یک بعدی (One dimensional gel electrophoresis) و الکتروفورز دو بعدیTwo) dimensional gel electrophoresis):
الكتروفورز یك بعدی- پروتئینها تنها براساس وزن مولكولی شان از هم جدا میشوند. این تکنیک برای جدا كردن پروتئینهایی با وزن مولكولی 10 تا300 کیلو دالتون بكار گرفته میشود معمولترین كاربرد الكتروفورز یك بعدی توصیف پروتئینها بعد از خالصسازی پروتئین میباشد.
الکتروفورز دوبعدی- از تواناییهای بالای الكتروفورز دو بعدی این است كه میتواند پروتئینهایی را كه تحت تأثیر تغییرات بعد از ترجمه قرار گرفتهاند جدا كند.بسیاری از انواع تغییرات پروتئینی، علاوه بر ایجاد تفاوت در وزن مولکولی پروتئین، سبب تفاوت در بار الکتریکی پروتئین نیز میشوند. اكثر فرمهای فسفوریله شده پروتئین میتوانند از فرمهای فسفوریله نشده به وسیله الكتروفورز دو بعدی جدا شوند كه در این مورد، یك فسفوپروتئین به صورت نقاط چندگانه بر روی ژل دو بعدی ظاهر میشود.
در الكتروفورز دو بعدی، پس از استخراج پروتئینها(Total Protein)، پروتئینها در بعد اول جداسازی، براساس بار الکتریکی (و یا بعبارت دیگر بر اساس نقاط ایزو الکتریک) بر روی ژلهای IPGs، Immobilized pH gradient، با محدوده pH برابر با 7-4، جدا میشوند. بعد دوم جداسازی بر روی ژلهای پلی اکریل آمید 12% (SDS-PAGE) انجام میشود که در آن پروتئینها براساس وزن مولكولی جدا میشوند. تركیب این دو تكنیك باعث ایجاد رزولوشن ( قدرت تشخیص) بالاتری نسبت به آنچه در الكتروفورز یك بعدی وجود دارد، میشود. در مرحله بعد اقدام به رنگ آمیزی پروتئینها میکنیم. رنگ آمیزی با کوماسی بلو از قدیمیترین روشهاست که امروزه نیز مورد استفاده قرار میگیرد اگرچه حساسیت کم آن که سبب نیاز به استخراج مقدار زیادی پروتئین میشود باعث شده که بتدریج رنگ آمیزی با نیترات نقره بدلیل حساسیت بیشترجایگزین آن شود، با این همه در بعضی موارد نیترات نقره با ویژگیهای ساختاری پروتئینها تداخل یافته و این امر سبب بروز انحراف در نتیجه گیری میشود.
پس از رنگ آمیزی پروتئینها، اقدام به عکس برداری از ژل پلی اکریل آمید میگردد. سپس، تغییرات کمی نقاط آشکار شده بر روی ژل که هریک متعلق به پروتئین متفاوتی هستند، توسط نرم افزار مربوطه مورد ارزیابی قرار میگیرد.
تغییرات بیان پروتئینها:
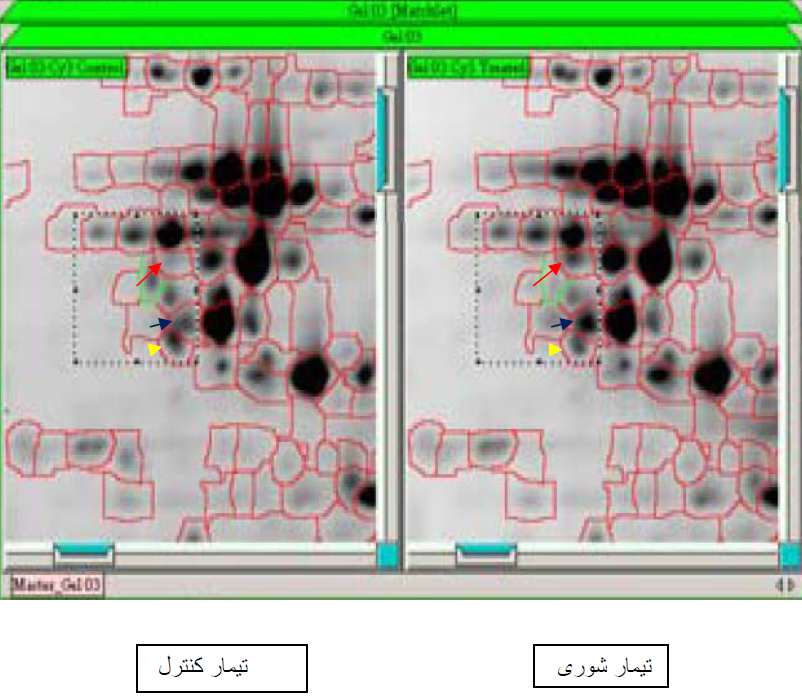
در تصویر گرفته شده از ژل پلی اکریل آمید، شاهد سه نوع تغییر در بیان پروتئینها خواهیم بود: حضور/حذف Absent/Present، افزایش بیان Up Regulated و یا کاهش بیان Down Regulated پروتئین. البته باید توجه داشت که هیچگاه میزان بیان یک پروتئین به صفر نخواهد رسید (حد آستانه) و عدم رویت نشانهای از بیان پروتئین در تصویر، به دلیل بیان بسیار اندک آن پروتئین میباشد. در تصویر زیر فلش قرمز نشان دهنده بیان (حضور) پروتئین اول، و فلش آبی بیانگر افزایش بیان پروتئین دوم و فلش سوم نشانگر کاهش بیان پروتئین سوم در شرایط تنش شوری نسبت به شرایط کنترل (نرمال) است.
شناسایی پروتئینها:
اگرچه الکتروفورز دو بعدی ابراز تفکیک کننده قدرتمندی است، ولی در بسیاری موارد دانستن نقطه ایزوالکتریک و وزن مولکولی برای شناسایی دقیق پروتئینها کفایت نمیکند، زیرا در برخی موارد دو یا چند پروتئین متفاوت ممکن است نقطه ایزو الکتریک و وزن مولکولی مشابهی داشته باشند. با این حال از این روش برای جداسازی پروتئینهای منفرد و تعیین خصوصیات آنها با روشهای دیگر استفاده میشود. در روش ادمن (Edman) از انتهای آمینی پروتئین توالی یابی میشود. سپس با استفاده از جستجوی توالی این ناحیه در پایگاه دادهها، پروتئین شناسایی میشود. در روشی دیگر میتوان پروتئین مورد نظر را از روی ژل جدا کرد و با استفاده از هضم آنزیمی، قطعات پپتیدی را به روش ادمن توالی یابی کرد. این روش از روش قبلی اطلاعات بیشتری را ارائه میکند. ولی باید توجه کرد که برای انجام این روش مقدار زیادی پروتئین نیاز است بعلاوه در بیش از 50 درصد پروتئینها انتهای آمینی بلوکه شده و نمیتوان آنها را توالی یابی کرد. این موارد موجب شده است که در اغلب موارد از طیف سنج جرمی (Mass Spectrometer) برای تعیین دقیق خصوصیات پروتئینهای تفکیک شده استفاده شود.
اسپكترومتر جرمی Mass Spectrometer
پس از شناسایی پروتئینهایی که بطور معنی دار تحت تنش عکسالعمل نشان دادهاند، این پروتئینها، جهت تعیین توالی جزیی و شناسایی نوع پروتئین، مورد آنالیز TOF/TOFMALDI از انواعMass Spectrometer قرار میگیرند. تكنیكMS ما را قادر میسازد كه در زمینه ساختار پروتئین مانند جرم پپتیدها یا توالیهای اسید آمینه، اطلاعاتی را بدست بیاوریم. این اطلاعات میتوانند به منظور شناسایی پروتئین یا جستجوی نوكلئوتید در بانك اطلاعاتی پروتئین مورد استفاده قرار بگیرند. تصویر زیر نمونه اتومات دستگاه MALDI را نشان میدهد:
بدست آوردن اطلاعات به وسیله MS میتواند به سه مرحله تقسیم شود:
آماده سازی نمونهها- شکستن پروتئینهای منفک شده با استفاده از عوامل شیمیایی یا پروتئازها (معمولاً تریپسین) به پپتید
یونیزاسیون نمونههای پپتیدی
آنالیزهای جرمی
در نهایت با مقایسه طیفهای حاصل از نمونه مورد بررسی با طیفهای فرضی که بر اساس توالیهای پپتیدی موجود در بانکهای اطلاعاتی پروتئینی، محاسبه شدهاند، امکان شناسایی توالیهای تشکیل دهنده پروتئین و در نهایت کل پروتئین فراهم میآید. تصویر زیر فرآیند پروتئومیکس را نشان میدهد:
بهینه سازی الکتروفورز دوبعدی:
استفاده از رنگهای فلورسنت جهت نشاندار کردن پروتئینها قبل از انجام بعد اول الکتروفورز
اتوماتكردن الکتروفورز دو بعدی
استفاده از كامپیوتر و بانکهای اطلاعاتی جهت آنالیز تصاویر ژلهای الکتروفورز دوبعدی
تكنولوژی الكتروفورز با ژل متفاوت(DIGE) - از دو رنگ متفاوت فلورسنتی برای نشاندار كردن پروتئین دو نمونه استفاده میشود و پروتئینهای نشاندار در همان ژل دو بعدی ران میشوند.
محدودیتهای الکتروفورز دوبعدی:
وقتگیر و پرزحمت میباشد، معادل PCR برای پروتئینها وجود ندارد و بنابراین قادر به شناسایی پروتئینهای با تعداد كپی كم (بیان اندک) نمیباشیم.
کاربرد الكتروفورز دو بعدی در پروتئومیكس:
پروفیلینگ بیان پروتئین : بیان پروتئین نمونهها بطور كمی و كیفی میتواند با هم مقایسه شود حضور یا عدم حضور نقاط (Spot) میتواند اطلاعاتی را در زمینه تفاوت در بیان پروتئین مهیا كند.
تهیه نقشه سلولی: این تکنیک برای تهیه نقشه پروتئینها در میكروارگانیسمها، اندامها و كمپلكسهای پروتئینی بكار میرود و میتواند برای تجزیه و تحلیل پروتئینها در ساب پروتئومهایی كه به وسیله بعضی فرمهای خالصسازی شده پروتئوم ایجاد شدهاند مورد استفاده قرار بگیرد.




 مقاله نقشه یابی مولکولی صفات گیاهان زراعی
مقاله نقشه یابی مولکولی صفات گیاهان زراعی توی پنجره دوجداره
توی پنجره دوجداره باردهی درختان ميوه به چه عواملی بستگی دارد
باردهی درختان ميوه به چه عواملی بستگی دارد آموزش جدا کردن پاجوش های آلوئه ورا
آموزش جدا کردن پاجوش های آلوئه ورا اطلاعات کامل درخت گلابی در ایران
اطلاعات کامل درخت گلابی در ایران معرفی گل درختچه ها آپارتمانی زیبا سازی باغچه
معرفی گل درختچه ها آپارتمانی زیبا سازی باغچه روش کاشت پیاز سنبل
روش کاشت پیاز سنبل شيره خام شيره پرورده درخت چیست
شيره خام شيره پرورده درخت چیست گل پیچ گلیسین
گل پیچ گلیسین گل یوکا نگهداری آن
گل یوکا نگهداری آن درخت آقطی سیاه
درخت آقطی سیاه